February 18, 2021. The 2nd International Specialized Conference on Contemporary Translation Technologies in the Pharmaceutical Industry
На сегодняшний день точный механизм высвобождения железа из ферритина, в котором оно накапливается, не установлен. Однако известно, что восстановление трехвалентного железа до его двухвалентной формы является частью этого процесса. Данные, полученные в ряде исследований на животных, позволили исследователям − доктору Мазур [Mazur] и его коллегам1,2 сделать предположение, что за восстановление железа отвечает фермент – ксантиноксидаза. Эта гипотеза3 подтвердилась, когда был зафиксирован первый случай заболевания ксантинурией, – значительным снижением активности печеночной ксантиноксидазы и повышенным уровнем содержания железа. Таким образом, появились первые основания полагать, что ингибирование активности ксантиноксидазы может привести к значительному изменению метаболизма железа.
Если бы аллопуринол влиял на метаболизм железа в каком-либо из двух депо, это было бы интересно как с физиологической, так и с клинической точки зрения. В настоящем исследовании выясняли наличие возможных изменений метаболизма железа у животных и у людей, получающих аллопуринол.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования на животных
Исследования проводили на самцах крыс линии Вистар, распределяя их по массе тела и возрасту. Абсорбцию железа оценивали натощак [после голодания в ночное время суток]. Железо в форме железа хлорида или железа аскорбата метили 59Fe и вводили через интра-эзофагеальную канюлю с оливой. В ходе экспериментов животных умерщвляли через 4 и 24 часа, соответственно. Желудочно-кишечный тракт (ЖКТ) полностью удаляли и в оставшейся части тушки определяли [радио]активность абсорбировавшегося [препарата] с использованием пластикового люминесцентного счетчика излучения от всего тела животного13. В других исследованиях [радиоизотопом] 59Fe метили трансферрин плазмы свежей крови, который вводили внутривенно. Животных умерщвляли через 24 часа и изучали распределение [радио]изотопа. Для исследования высвобождения железа из депо ретикулоэндотелиальной системы внутривенно вводили поврежденные нагреванием эритроциты крысы, ранее получавшей 59Fe. Крыс умерщвляли через определенные промежутки времени и измеряли количество удержанного изотопного железа в печени и селезенке. Водную суспензию аллопуринола** вводили внутрь 3 раза в сутки в дозе 40-120 мг/кг массы тела через интра-эзофагеальную канюлю с оливой. В других экспериментах препарат вводили внутримышечно два раза в сутки в общей дозе 60 мг/кг массы тела. Растворения чистого вещества в виде порошка# добивались путем добавления 0,01M NaOH, при этом животным контрольной группы вводили аналогичный объем физиологического раствора, кислотность которого доводили до такого же значения с помощью NaOH.
Исследования на людях
Для изучения абсорбции железа у добровольцев из числа госпитализированных пациентов, у которых не было выявлено признаков гематологических, неопластических или инфекционных заболеваний, использовали метод с двумя изотопами. Каждому пациенту натощак вводили 5 мг железа в форме сульфата двухвалентного железа, меченного 80 мкг 55Fe или 7 мкг 59Fe. После введения контрольной дозы сульфата железа, меченной одним изотопом, пациенты получали 200 мг аллопуринола 3 раза в сутки в течение 7 дней, а затем им вводили сульфат железа, меченный вторым изотопом. Через две недели забирали образцы крови, проводили отмывку эритроцитов, осаждали железо и определяли содержания 59Fe и 55Fe с использованием спектрометра компании "Пакард Трикарб" [Packard Tricarb] (модель 3002) по методике, описанной Кац [Katz] и соавторами14.
Были обследованы 33 пациента с подагрой, которые получали аллопуринол в дозе 100-700 мг в сутки от 2 месяцев до 2 лет. Через регулярные промежутки времени проводили анализ гемоглобина и гематокрита. У 26 пациентов измеряли содержание железа в сыворотке крови с использованием модифицированного метода по Ботуэлл и Маллетт15 [Bothwell & Mallett]. Ненасыщенную железосвязывающую способность сыворотки определяли методом по Чарлтон [Charlton] и соавт16. Хелатируемое железо в организме измеряли у девяти из этих пациентов; еще у пяти пациентов с подагрой, не получавших аллопуринол, проведен тест дифференциальной экскреции ферриоксамина17.
РЕЗУЛЬТАТЫ
Абсорбция железа
Введение аллопуринола не оказывало значительного влияния на абсорбцию железа у девяти участников исследования. Средняя контрольная абсорбция составила 11,3 %, а после введения аллопуринола – 14,3 % (p > 0,1 в тесте парных выборок по критерию Вилкоксона).
В исследованиях на крысах доза аллопуринола, форма радиоактивного изотопа и количество железа-носителя варьировались. Результаты этих экспериментов приведены в Таблице 1. Через 4 часа значимой разницы между абсорбцией аллопуринола у крыс контрольной группы и у крыс, получавших аллопуринол, не наблюдалось. Тем не менее, через 24 часа средняя абсорбция у крыс, получавших аллопуринол, была гораздо ниже, чем в контрольной группе животных, однако разница с уровнем значимости, равным 0,05, была достигнута только в одном эксперименте. В этом эксперименте участникам исследования вводили 10 мкг железа хлорида и 120 мк/кг аллопуринола в течение 21 дня. Средняя абсорбция (± СО) составила 23,9 % (±3,0) в группе аллопуринола и 38,1 % (±18,3) в контрольной группе животных.
Концентрация железа в сыворотке крови и ненасыщенная железосвязывающая способность сыворотки
У испытуемых пациентов аллопуринол не оказывал заметного влияния на концентрацию железа в сыворотке крови или на ненасыщенную железосвязывающую способность сыворотки. Наблюдения были собраны у шести из девяти пациентов, не страдающих подагрой, которые приняли участие в исследованиях абсорбции железа. Во время приема аллопуринола в дозе 600 мг в сутки в течение семи дней средняя концентрация железа в сыворотке крови составляла 99 % от значения, зарегистрированного до начала приема препарата, а после завершения курса приема препарата значение этого показателя составило 98 %. Соответствующие значения по показателю средней ненасыщенной железосвязывающей способности сыворотки составили 92 % и 113 %. Также были обследованы 26 пациентов с подагрой, получавших аллопуринол от 4 до 24 месяцев (в среднем в течение 11,5 месяцев). Единственными отклонениями от нормы была концентрация железа в сыворотке крови (40 мкг/100 мл) и ненасыщенная железосвязывающая способность сыворотки (353 мкг/100 мл) у пациента, который получал терапию дефицита железа до начала лечения аллопуринолом. Средняя концентрация железа в сыворотке крови (± СО) у этой группы пациентов в целом составила 104 (± 24) мкг/100 мл, а средняя ненасыщенная железосвязывающая способность сыворотки – 217 (± 44) мкг/100 мл.
На крысах также проводили краткосрочные эксперименты. Воздействие однократного внутримышечного введения аллопуринола в дозе 100 мг/кг изучали на группах по 10 крыс в каждой, через различные промежутки времени в течение 24 часов. Через 7, 8 и 10 часов после введения препарата средняя концентрация железа в сыворотке крови составила 134 (± 34), 127 (± 44) и 151 (± 16) мкг/100 мл, соответственно, по сравнению со 166 (± 29), 208 (± 35) и 277 (± 74) мкг/100 мл в контрольных группах у животных, которым вводили физиологический раствор. Эти различия были значимыми на уровне 0,05, 0,001 и 0,001, соответственно. В другом эксперименте аллопуринол вводили перорально в дозе 120 мг/кг в течение 3 недель 19-ти крысам. К концу этого периода средняя концентрация железа в сыворотке крови (± СО) этих животных составила 242 (± 61) мкг/100 мл по сравнению с 259 (± 52) мкг/100 мл у 22 крыс контрольной группы. Эта разница не была значимой (t = 0,92, p > 0,1).
Уровень запаса железа
Для оценки запаса хелатируемого железа у девяти пациентов с подагрой, которые получали лечение аллопуринолом в течение 4,3–19,8 месяцев (в среднем 13,7 месяцев), использовали тест дифференциальной экскреции ферриоксамина. Существенной разницы между этими испытуемыми и 5-ю другими пациентами с подагрой, которые получали лечение другими препаратами, не выявлено (t = 0,88, p > 0,3). Средние значения (± СО) составили 554 (± 195) и 442 (± 283) мкг ферриоксамина на кг массы тела, соответственно.

Распределение железа, связанного с трансферрином
Распределение 59Fe, связанного с [трансферрином] плазмы крови, изучали на крысах через 24 часа после его внутривенного введения. В этом эксперименте участвовали 15 животных, которые получали аллопуринол в дозе 120 мг/кг в течение 7 дней, и 15 крыс в контрольной группе. Процентное содержание 59Fe в печени, кишечнике и остове животных составило 11,9 (± 2,5), 5,1 (± 1,1) и 74,5 (± 3,2), а у крыс контрольной группы – 11,7 (± 3,1), 5,7 (± 1,2) и 73,9 (± 4,1), соответственно. Ни одно из этих различий не было значимым (печень t = 0,16, р > 0,8; кишечник t = 1,51, p > 0,1; остов t = 0,45, p > 0,6).
Мобилизация железа из запасов в организме человека и его использование
Измеряли уровень гемоглобина и гематокрита у 33 пациентов, получавших терапевтические дозы аллопуринола в период от 2 месяцев до 2 лет (в среднем 9,9 месяцев), для оценки эффективности повторного использования железа из депо ретикулоэндотелиальной системы. Показатели гемоглобина и гематокрита практически не изменялись на протяжении всего периода наблюдения. Последние зарегистрированные показатели гемоглобина и гематокрита, выраженные в процентном соотношении от значений, установленных до начала лечения, варьировались от 90 до 124 (в среднем 104) и от 89 до 121 (в среднем 102), соответственно.
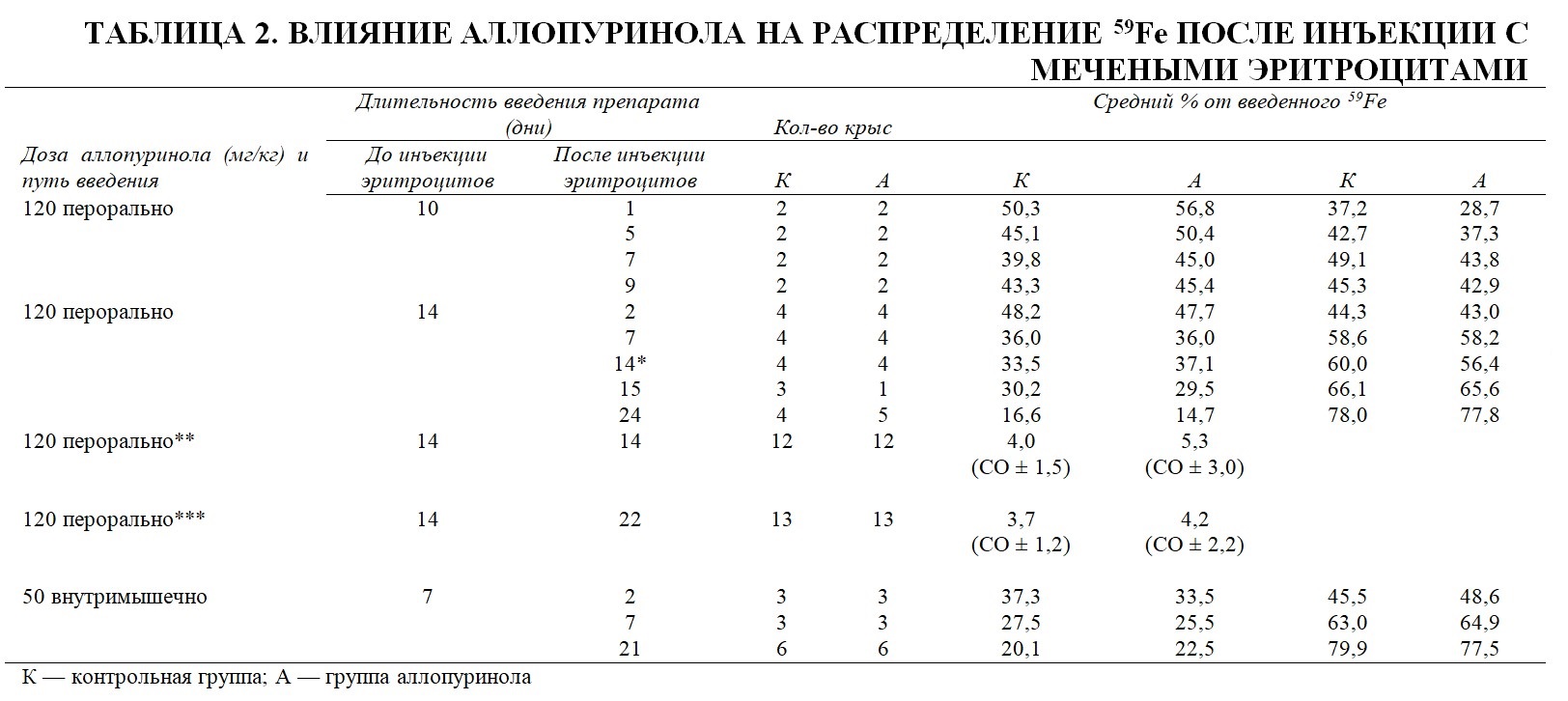
Мобилизацию железа из депо ретикулоэндотелиальной системы изучали на крысах, которым внутривенно вводили поврежденные нагреванием эритроциты, содержащие 59Fe-гемоглобин. Общую радиоактивность печени и селезенки использовали для подтверждения снижения удержания железа в депо, а радиоактивность остова – для подтверждения повышения включения радиоактивного железа в циркулирующий гемоглобин (Таблица 2). Провели несколько экспериментов, в которых животных умерщвляли с различными интервалами в течение 24 дней после инъекции с мечеными изотопами эритроцитов. Проводили различные процедуры стимуляции потребности высвобождения железа из депо для выявления возможного ингибирования высвобождения железа аллопуринолом. В этих процедурах применяли повторное кровопускание для стимуляции активности костного мозга, использовали крысят-отъёмышей, у которых потребности в железе были выше, чем у взрослых животных, а также придерживались несодержащего железа рациона для устранения его поступления с пищей. Даже при одновременном воздействии суммы этих факторов не было получено доказательств того, что аллопуринол влияет на мобилизацию железа из депо и его использование [в организме].
ОБСУЖДЕНИЕ
Результаты, полученные в ходе клинических исследований и представленные в этой работе, подтверждают выводы других ученых4-6, которые пришли к выводу, что ингибирование ксантиноксидазы аллопуринолом при его применении в терапевтических дозах не оказывает заметного влияния на метаболизм железа у человека. Так, во время введения аллопуринола пациентам в течение различных интервалов времени не было выявлено каких-либо изменений показателей абсорбции железа, концентрации железа в сыворотке крови, ненасыщенной железосвязывающей способности сыворотки, концентрации гемоглобина, гематокрита и запасов хелатируемого железа в организме.
В экспериментах на крысах аллопуринол вводили в количествах, в 5-20 раз превышающих терапевтические дозы препарата, применяемые на людях, в пересчете на массу тела. За некоторыми исключениями, в данных экспериментах подтвердились результаты, полученные в ходе клинических исследований. Аллопуринол не влиял ни на распределение в организме радиоактивного железа, связанного с трансферрином, ни на мобилизацию меченого железа из депо селезенки и печени. Даже когда потребность костного мозга [в железе] у растущего организма крысят была усилена повторным кровопусканием, а из питания было исключено железо для усиления зависимости от эндогенных запасов, аллопуринол не влиял на восполнение гемоглобина с использованием депо железа в организме.
В течение первых 4 часов после введения крысам меченого железа аллопуринол не влиял на его абсорбцию. Тем не менее, явное снижение абсорбции наблюдалось при ее измерении через 24 часа, однако разница была статистически значимой только при очень высоких дозах аллопуринола (120 мг/кг) и при введении железа в форме хлорида железа. Эти данные свидетельствуют о том, что аллопуринол может препятствовать медленному высвобождению железа из ферритина клеток слизистой оболочки, наличием которого, как считается, можно объяснить позднюю фазу абсорбции железа. В рамках настоящего исследования не было получено данных, подтверждающих предположение3,9,18 о том, что ингибирование ксантиноксидазы может приводить к увеличению абсорбции железа.
Примечания
*Кровопускание на 14-й и 21-й дни.
**Отъёмыши, кровопускание на 1-й и 7-й дни. Средний уровень гемоглобина на момент кровопускания 15,7 и 16,0, 12,4 и 13,0; 9,1 и 8,0 г/100 мл на момент умерщвления (контрольная группа и группа аллопуринола, соответственно).
***Отъёмыши, питание без содержания железа, кровопускание на 8-й и 15-й дни. Средний уровень гемоглобина на момент кровопускания 15,9 и 16,2, 12,6 и 13,6; 9,0 и 8,4 г/100 мл на момент умерщвления.
При изучении влияния аллопуринола на концентрацию железа в сыворотке крови крыс выявлен значительно более низкий уровень железа в сыворотке крови между 7 и 10 часами после однократной внутримышечной инъекции препарата в дозе 50 мг/кг по сравнению с крысами контрольной группы. Это различие было в большей степени обусловлено увеличением концентрации железа в сыворотке крови у крыс контрольной группы, чем ее снижением у животных в группе введения препарата. Суточные колебания концентрации железа в сыворотке крови хорошо изучены19, что позволило выявить подавление нормального увеличения этой концентрации в группе введения аллопуринола. Было показано, что при наличии скипидарных абсцессов уровень железа в сыворотке крови у крыс снижается20, что, предположительно, обусловлено ингибированием высвобождения железа из депо ретикулоэндотелиальной системы в результате развития воспалительной реакции. Возможно, но не доказано, что аллопуринол, обладающий относительно низкой растворимостью при физиологическом уровне кислотности, мог вызвать развитие аналогичной реакции. В результате отсутствия влияния на уровень железа в сыворотке крови при пероральном введении аллопуринола в течение 3 недель в высоких дозах (120 мг/кг) подтверждается вероятность взаимосвязи наблюдавшегося изменения при внутримышечном введении аллопуринола с самой инъекцией, а не с ингибированием ксантиноксидазы.
Имеющиеся данные о том, что ксантиноксидаза играет важную роль в высвобождении железа из ферритина, правдоподобны, но неубедительны. Первоначально гипотеза была выдвинута учеными Грин и Мазур1 [Green & Mazur] в результате экспериментов на крысах и срезах печени крыс. Ксантиноксидаза принимает электрон от ксантина и других пуриновых субстратов и передает его молекулярному кислороду или другим акцепторам электронов. Одним из таких акцепторов является ферритин, трехвалентное железо в составе которого восстанавливается и легче диссоциирует от белка. Имеются веские доказательства того, что это может происходить. Однако нет уверенности в том, что процесс высвобождения железа из этого депо обусловлен исключительно активностью ксантиноксидазы. Убедительные данные в поддержку гипотезы Грин и Мазур [Green & Mazur] первоначально были получены благодаря описанию пациента с ксантинурией и значительным снижением активности ксантиноксидазы в печени, связанным с гемохроматозом3. Однако на сегодняшний день зарегистрирован только один такой пациент, а также пациент с ксантинурией и нормальным метаболизмом железа21. У зарегистрированного пациента была значительно снижена активность ксантиноксидазы на основании результатов исследования биоптатов кишечника и печени (менее 0,1 % от активности у здоровых людей). Поэтому связь с перегрузкой железом у первого пациента могла быть случайной. Ученые Мазур и Саклер22 [Mazur & Sackler] сообщили о снижении активности ксантиноксидазы по результатам исследования биоптата печени у пациентов с гемохроматозом или циррозом печени. Они предположили, что перегрузка железом была обусловлена ферментной недостаточностью. Однако тот факт, что у пациентов с идиопатическим гемохроматозом железо после кровопускания может легко мобилизовываться из депо19,23, указывает на то, что это патологическое состояние не является результатом блокирования высвобождения железа из запасающих его соединений.
К сожалению, в настоящем исследовании не получено дополнительных данных о роли ксантиноксидазы в высвобождении железа из ферритина. Тот факт, что в исследовании не было показано наличия влияния аллопуринола на метаболизм железа у человека, не доказывает отсутствие у ксантиноксидазы существенной роли в высвобождении железа. Во-первых, фермент, вероятно, ингибируется в недостаточной степени при применении аллопуринола в терапевтических дозах. Если предполагаемые реакции высвобождения железа с участием ксантиноксидазы являются стехиометрическими, то для восстановления 1 моля железа потребовалось бы окисление 1 моля ксантина. Общий суточный обмен пуринов у человека, при его измерении по показателю выработки мочевой кислоты, составляет 3-4 миллимоля, тогда как общая суточная абсорбция железа составляет всего около 0,015-0,030 миллимолей (1-2 мг). Следовательно, даже при ингибировании ксантиноксидазы на 99 % не будет наблюдаться влияния на абсорбцию железа. Несмотря на то, что каждый день из депо высвобождается гораздо больше железа, чем всасывается из кишечника, это количество составляет всего 35 мг (0,53 миллимоля). Поскольку при применении аллопуринола в терапевтических дозах активность ксантиноксидазы не ингибируется более чем на 50 %, влияния на метаболизм железа не предполагается24. Более того, аллопуринол сам по себе является субстратом ксантиноксидазы – он отдает ей электрон и окисляется до аллоксантина. Таким образом, теоретически, железо в составе ферритина может восстанавливаться даже в присутствии этого препарата.
РЕЗЮМЕ
Исследовали теоретическую возможность влияния ингибирования ксантиноксидазы аллопуринолом на высвобождение железа из запасающего его соединения – ферритина на здоровых добровольцах, пациентах с подагрой и крысах.
У пациентов с подагрой и без нее, получавших аллопуринол в терапевтических дозах, не выявлено каких-либо изменений показателей абсорбции железа, концентрации железа в сыворотке крови, ненасыщенной железосвязывающей способности сыворотки, концентрации гемоглобина, гематокрита и запасов хелатируемого железа в организме. В ходе экспериментов на крысах аллопуринол вводили в количествах в 5-20 раз превышающих [терапевтические дозы препарата, применяемые в клинических исследованиях, в пересчете на массу тела человека] при этом воздействия на распределение в организме радиоактивного железа, связанного с трансферрином, и на мобилизацию железа из депо селезенки и печени не выявлено. Однако, по всей видимости, у крыс имелось некоторое уменьшение абсорбции железа в поздней фазе.
При пероральном введении аллопуринола крысам какого-либо воздействия на уровень железа в сыворотке крови не выявлено, однако после внутримышечной инъекции препарата наблюдалось значительное его снижение. Нельзя исключить возможность того, что это было связано с развитием воспалительной реакции, а не с ингибированием ксантиноксидазы.
Настоящее исследование проведено при поддержке Южно-Африканского Совета по атомной энергетике и частично профинансировано грантом (AMO 4912-07) от Национального института здравоохранения США.
*Статья написана 28 марта 1968 года
**Зилоприм (Zyloprim) в таблетках компании "Берроуз Уэлкам и Ко. Лтд" (Южная Африка) [Burroughs Wellcome & Co. (SA) Ltd.]
#Аллопуринол, лиофилизат для приготовления р-ра для инъекций (серия AN 47981) получен от компании "Берроуз Уэлкам и Ко. Инк” (США), Такахо, шт. Нью-Йорк, США [Burroughs Wellcome & Co. (USA) Inc., Tuckahoe, NY, USA]
REFERENCES:
1. Green, S. and Mazur, A. (1957): J. Biol. Them., 227, 653.
2. Mazur, A., Green, S., Saha, A. and Carleton, A. (1958): J. Clin. Invest., 37, 1809.
3. Ayvazian, J. H. (1964): New Engl. J. Med., 270, 18.
4. Rundles, R. W., Metz, E. N. and Silberman, H. R. (1966): Ann. Intern. Med., 64, 229.
5. Emmerson, B.T. (1966): Ann. Rheum. Dis., 25, 700.
6. Davis, P. S. and Deller, D. J. (1966): Lancet, 2, 470.
7. Udall, V. and Bushby, S. R. M. (1966): Ann. Rheum. Dis., 25, 704.
8. Kozma, C., Salvador, R. A. and Elion, G. B. (1967): Lancet, 2, 1040.
9. Powell, L. W. (1966): Ann. Rheum. Dis., 25, 697.
10. Gevirtz, N. R. (1967): Lancet, 2, 715.
11. Charlton, R. W., Jacobs, P., Torrance, J. D. and Bothwell, T. H. (1965): J. Clin. Invest., 44, 543.
12. Wheby, M. S. and Crosby, W. H. (1963): Blood, 22, 416.
13. Warner, G. T. and Oliver, R. (1962): Brit. J. Radiol., 35, 349.
14. Katz, J. H., Zoukis, M., Hart, W. L. and Dern, R. J. (1964): J. Lab. Clin. Med., 63, 885.
15. Bothwell, T. H. and Mallet, B. (1955): Biochem. J., 59, 599.
16. Charlton, R. W., Hardie, N. and Bothwell, T. H. (1965): S. Afr. J. Med. Sci., 30, 71.
17. Fielding, J. (1965): J. Clin. Path., 18, 88.
18. Crosby, W. H. (1964): New Engl. J. Med., 270, 535.
19. Bothwell, T. H. and Finch, C. A. (1962): Iron Metabolism, p. 388. Boston: Little, Brown.
20. Cartwright, G. E., Gubler, C. J. and Wintrobe, M. M. (1950): J. Biol. Chem., 184, 579.
21. Engelman, K., Watts, R. W. E., Klineberg, J. R., Sjoerdsma, A. and Seegmiller, J. E. (1964): Amer. J. Med., 37, 839.
22. Mazur, A. and Sackler, M. (1967): Lancet, 1, 254.
23. Crosby, W. H., Conrad, M. E. jnr. and Wheby, M. S. (1963): Blood, 22, 429.
24. Elion, G. B. (1967): Personal communication.
S. A. Medical Journal
(Supplement – South African Journal of Laboratory and Clinical Medicine)
Date of Issue: 3 August 1968
Translation from English into Russian
Translated by: K.S. SHAVRINA
Edited by: D.E. NEDOSPELOV
February 6, 2021
Download original text
Hide






